Täiendav patendikaitse meditsiini- ja taimekaitsetoodetele
2004. aastal liitus Patendiamet Euroopa praktikaga ning hakkas välja andma tunnistusi, millega pikendatakse patentide tavapärast kehtivusaega. Patentide maksimaalne kehtivusaeg on üldjuhul 20 aastat. Täiendavat kaitset ei saa kõik patendid, vaid seda antakse ainult meditsiini- ja taimekaitsetoodetele. Selline lähenemine võib tekitada küsimusi. Patendikaitse kehtivus originaalravimitele ja taimekaitsetootele kestab ju samuti kuni 20 aastat alates patenditaotluse esitamise kuupäevast. Miks siis selline eelis teatud leiutiste grupile? Kuna ravimi (või taimekaitsevahendi) ohutuse ja efektiivsuse uuringud on väga pikad, võib patendi kehtivuse algusest müügiloa ja reaalse turunduseni jõudmiseni kuluda aastaid. Seega võib reaalne monopoolne turundusperiood ilma täiendavate võimalusteta suhteliselt lühikeseks jääda. Sellisel juhul võib ravimi väljatöötamine muutuda majanduslikus mõttes väga ebaefektiivseks ning kasumi teenimise asemel võib ettevõtjat oodata ebastabiilne finantsolukord, kui mitte tootmise sulgemine. Seetõttu leitakse, et patendi omanikule tuleks anda võimalus kaitsta ravimite ja taimekaitsevahendite õigusi pikema aja vältel. Muidugi ei saa see protsess olla kaootiline.
On olemas Euroopa regulatsioon, mis suunab intellektuaalse omandi (IO) organisatsioone ühesuguse skeemi järgi käituma. Reeglitele peavad alluma nii patendiomanikud kui ka IO-spetsialistid. Patendiomanikul peab olema kehtiv patent ning toimeainel vastav müügiluba. Ka avalduse esitamise kuupäev ei ole suvaline, see peab jääma 6 kuu sisse kas patendi või müügiloa väljastamisest. IO-spetsialist aga arvutab patendikehtivuse lisaaja valemi alusel. Täiendav kaitse ei tohi olla pikem kui 5 aastat. Erand on tehtud pediaatrias kasutatavatele ravimitele. Siin on patendi pikendamise maksimaalne aeg 5 aastat ja 6 kuud.
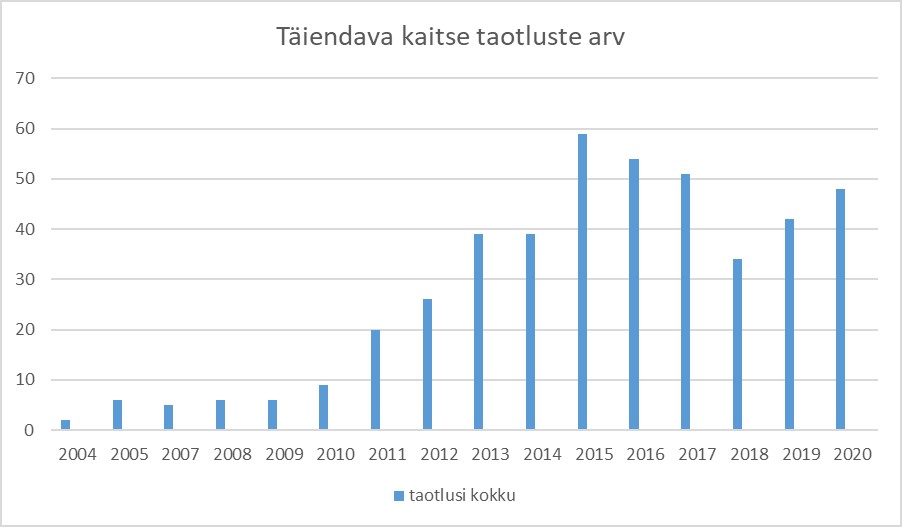
Samas on ka meie teadmistepagas aastatega tunduvalt kasvanud. Ka statistikat vaadates on näha, et kui aastal 2004 võtsime menetlusse ainult kaks täiendava kaitse taotlust, siis viimastel aastatel on see number Patendiametis 40–50 ringis (vt diagrammi). Iga taotlusega saame kogemusi ja kindlust juurde.
Enamik Eestis väljastatud täiendava kaitse tunnistusest kuuluvad meditsiinitoodetele ehk ravimi toimeainetele.
Rohkem infot esitatud täiendava kaitse taotluste, nende staatuste ja toimeainete nimetuste kohta leiate Patendiameti kodulehelt rubriigi alt „Leiutiste andmebaasid“ tabelist "Meditsiini- ja taimekaitsetoodete täiendava kaitse taotlused (SPC)".




